2023-11-17 12:47:51 发布人:hao333 阅读( 4547)
就在今天,我们见证了生物技术发展的一个新的里程碑。一款基于CRISPR基因编辑技术的疾病疗法,获得了英国药品和健康产品管理局的有条件上市许可,成为全世界首款获得...
就在今天,我们见证了生物技术发展的一个新的里程碑。一款基于CRISPR基因编辑技术的疾病疗法,获得了英国药品和健康产品管理局的有条件上市许可,成为全世界首款获得监管机构批准上市的CRISPR基因编辑疗法。
这款疗法的商品名为Casgevy,由福泰制药和CRISPR Therapeutics公司联合开发,用于治疗两种遗传性血液疾病——输血依赖型β-地中海贫血和镰刀状细胞贫血病。
顶尖学术期刊《自然》的新闻报道援引英国牛津大学遗传学家Kay Davies教授的评论:“这是一个具有里程碑意义的批准,为未来CRISPR疗法的进一步应用打开了大门,有潜力治愈许多遗传疾病。”
镰刀状细胞贫血病是一种由遗传突变引起的疾病,患者的血红蛋白变得容易连接在一起,这会将红细胞从正常的柔性圆形转变成缺乏柔性的月牙形,犹如镰刀状。这些畸形细胞会堵塞血管,导致血管闭塞、损伤血管壁,造成威胁生命的血栓。
图片来源:123RF
β-地中海贫血同样是一类基因疾病,正常情况下,血红蛋白会由α链和β链组成,但β-地中海贫血患者由于基因突变,无法产生足够的β链,因此红细胞结合铁的能力大大受损。患者需要定期接受输血治疗,但由于患者无法制造有效的红细胞,输血获得的铁无法消耗,长此以往会导致身体积累大量的铁,损伤器官功能。近些年来,随着帮助身体排铁的药物出现,β-地中海贫血患者的生活质量有了一定改善,但还是有很大的药物负担。 两类患者都亟需一种 新的治疗方式。
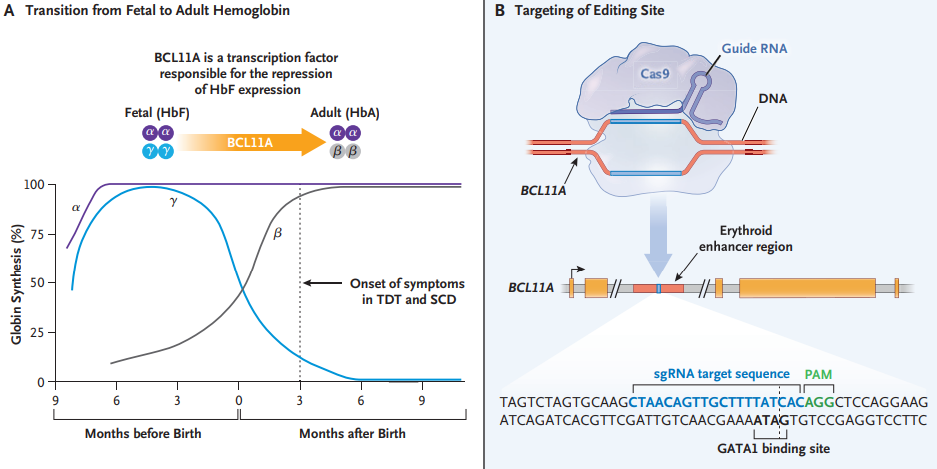
如今,Casgevy成为了一种可以治疗两种疾病的全新策略,它借助基因编辑的手段改造了患者自身的造血干细胞,让细胞能产生高水平的胎儿血红蛋白,这是一种完全健康,可以正常携带氧气的血红蛋白形式。但胎儿血红蛋白只会在胎儿发育过程中产生,出生后它的表达通路就被关闭了。
而某些特殊案例显示,当BCL11A基因突变时,一些成年人也能生成胎儿血红蛋白。而Casgevy做的事情,就是模拟这种突变,利用基因编辑的手段将患者造血干细胞的BCL11A进行切割,松开胎儿血红蛋白的刹车。
据已公布在《新英格兰医学杂志》的论文,实际操作中,研究团队需要先从患者体内收集造血干细胞,然后送到实验室进行基因编辑改造。与此同时,患者在重新接受干细胞回输之前,还要消除掉骨髓中原本的天然造血干细胞,这一步骤非常重要,一是减少后续异常血红蛋白的表达,二是为新来的基因编辑造血干细胞留出生长的空间。

由于这种清除天然干细胞的过程需要使用化疗药物,因此患者在此阶段可能会经历一定程度的副作用,并且免疫力会有所降低。他们需要提前在医院接受特殊护理至少一个月,防止产生感染。
根据第一批接受治疗患者的观察结果,患者会出现恶心、疲劳、发烧等副作用,但并没有出现严重的治疗安全问题。患者1在接受治疗6个月内,表达胎儿血红蛋白的红细胞比例会从基础的10.1%升至99.7%,并且能维持到18个月后。患者2表达胎儿血红蛋白的红细胞比例则在5个月升至99.9%,并且到第15个月还能维持近100%。
▲ 研究示意图
在长期随访中,研究团队可以在患者体内检测到高水平的胎儿血红蛋白,同时患者的血管闭塞性疼痛消失了,也不再需要接受输血治疗。可以说,基因编辑疗法让他们获得新生。
继英国之后,Exe-cel还有望在其他一些国家地区获批上市。据了解,Exe-cel目前正在接受欧洲药品管理局、美国食品药品监督管理局、沙特食品药品监督管理局的审评。近日,美国FDA召开细胞、组织和基因治疗咨询委员会会议,就exa-cel用于治疗镰刀状细胞贫血病患者的生物制品许可申请进行讨论,就该疗法潜在的脱靶效应咨询外部专家的意见。
CRISPR Therapeutics公司的首席执行官Samarth Kulkarni博士在新闻媒体中表示:“基因组编辑很特别,它可能会重新定义未来30-40年的医学范式。Exa-cel的批准代表了它的开始。”
目前,其他几款目前在研的CRISPR疗法同样受到关注。包括Intellia Therapeutics与再生元共同开发的在研CRISPR体内基因组编辑疗法NTLA-2001,1期临床试验的积极初步数据显示可改善转甲状腺素蛋白淀粉样变性,即将进行全球3期试验。Verve Therapeutics基于CRISPR系统改造的单碱基编辑疗法VERVE-101,可以靶向特定基因修改单个字母,在前不久公布的1b期临床试验结果中显示出一次性永久降低心血管疾病风险的潜力。
相关阅读
RelatedReading猜你喜欢
Guessyoulike